كتاب المنهج المساند علوم Timss للصف الثامن الفصل الاول
قراءة و تصفح
للتحميل:
وصف الكتاب
كتاب المنهج المساند علوم Timss للصف الثامن الفصل الاول
نقدم لكم كتاب المنهج المساند علوم Timss للصف الثامن الفصل الاول
كتاب المنهج المساند علوم Timss للصف الثامن الفصل الاول بإمكانكم تحميل هذا الملف على شكل بي دي إف PDF جاهز للتشغيل على أي جهاز لوحي أو إلكتروني أو كمبيوتر عن طريق زر التحميل في الأعلى, كما يمكنكم تصفح الملف فقط من خلال هذه الصفحة من الموقع مباشرة
الفهرس
- الجدول الدوري الحديث
- الروابط الكيميائية
- التفاعلات الكيميائية
- المعادلة الكيميائية
- سرعة التفاعلات الكيميائية
- المعادلة الكيميائية
- أسئلة TIMSS في مجال الكيمياء
- أسئلة TIMSS في مجال الفيزياء
- أسئلة TIMSS في مجال الجيولوجيا
الجدول الدوري الحديث :
تطلب منك والدتك احيانا ان تشتري مستلزمات المنزل وتزودك بقائمة بها عند ذهابك الى الجمعية التعاونية هل تستطيع الحصول على محتوى هذه القائمة الطويلة بسهولة ؟ كيف ؟
هل تعلم ان علماء الكيمياء لديهم قائمة طويلة من العناصر المختلفة في الخاص فبعضها اكثر نشاطا لانها تدخل في التفاغلات لتكون المركبات الكيميائية و بعضها اقل نشاطا و بعضها الاخر لا يكون مركبات لانه لا يدخل في التفاعلات الكيميائية و لذلك سعوا على مر العصور الى ترتيب العناصر حتى نجحوا في تصميم الجدول تظهر فيه العناصر كل منها في نموذج كل منها في نموذج متكرر و منتظم يسمى الجدول الدوري الحديث .
ما المبدأ الذي استخدم في ترتيب العناصر في الجدول الدوري ؟ و ما الهدف من هذا الترتيب ؟
و ما مكونات الجدول الدوري الحديث ؟
كيف نستقرئ مكونات الجدول الدوري الحديث ؟
ادرس الجدول الدوري جيدا ثم اجب عما يليه:
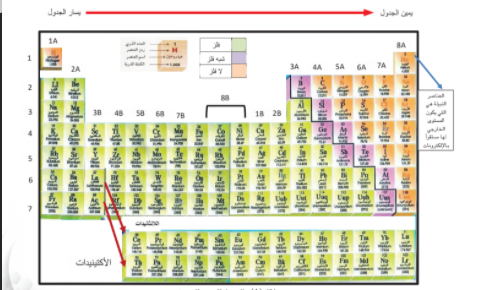
1_ ما عدد الصفوف الافقية في الجدول الدوري الحديث الدورات ؟
2 _ ما عدد الاعمدة الرأسية في الجدول الدوري الحديث المجموعات ؟
3 _ استدل على البيانات الموودة من الشكل الذي امامك ثم اكتبها في المكان المناسب
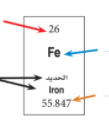
يحتوي الجدول الدوري على اكثر من 100 عنصر و لكل عنصر مربع منفصل
4 _ كيف تم ترتيب العناصر و تصنيها في الجدول الدوري الحديث ؟ و من اي جهة تبدأ في الجدول الدوري ؟
نلاحظ في الجدول الدوري ان مجموعات قسمت الى مجموعات يرمز لها بالرمز (A ) ومرقمة من 1 الى 8 و مجموعات يرمز لها بالرمز (B) و تتكون من 10 اعمدة
تذكر ان : الالكترونات في الذرة يتم توزيعها في 7 مستويات رئيسية حول النواة
1 _ المستوى الاول الاقرب للنواة : يشبع ب 2 الكترون و يستقر ب 2 الكترون
2 _المستوى الثاني : يشبع ب 8 الكترونات و يستقر ب 8 الكترونات
3 _ المستوى الثالث : يتشبع ب 18 الكترون و يستقر ب 8 الكترونات
ما العلاقة بين عدد الالكترونات في المستوى الخارجي و رقم المجموعة ؟
عناصر الدورة الثالثة من الجدول الدوري الحديث

استكمل التوزيع الالكتروني لعناصر الدورة الثالثة من جهة اليسار الى اليمين في الجدول الدوري الحديث كما في الشكل السابق ثم اجب عما يلي :
1 _ تدرج العدد الذري للعناصر يزداد او يقل
2 _عدد مستويات الطاقة
3 _ الخواص الفلزية
4 _الخواص اللافلزية
اذا علمت ان عدد الالكترونات في المستوى الخارجي يدل على رقم المجموعة و عدد مستويات الطاقة يدل على رقم الدورة التي يقع فيها العنصر فكيف يمكنك ان تحدد موقع العنصر في الجدول الدوري ؟
اكمل الجدول الدوري التالي لتحدد كلا من الدورة و المجموعة التي يقع فيها كل عنصر :
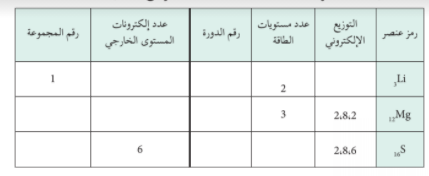
قارن بين عدد الدورات في الجدول الدوري و عدد مستويات الطاقة في الذرة
تحقق من فهمك :
رتبت عناصر الجدول الدوري بحسب تزايد العدد الذري للعنصر من جهة اليسار الى اليمين بحيث تزيد كل ذرة بروتونا واحدا عن الذرة التي تسبقها في الترتيب و كل عنصر له مربع منفصل عن بقية العناصر و يحتوي على بيانات مهمة من مثل العدد الذري اسم العنصر رمزه الكتلة الذرية و يخرج من الدورة السادسة صف من العناصر يسمى اللانثانيدات و يخرج من الدورة السابعة صف من العناصر يسمى الاكتينيدات و هذه العناصر توضع بصورة منفصلة للحفاظ على الدول من الانساع الزائد
المجموعات :
1 _ عددها 18 عمودا
2 _ عناصر المجموعة الواحدة تتشابه في خواصها
3 _عناصر المجموعة الواحدة تتشابه في عدد الكترونات المستوى الخارجي
4 _ عدد الكترونات مستوى الطاقة الخارجي في ذرة العنصر يدل على رقم المجموعة في عناصر المجموعة الاولى
الدورات :
1 _ عددها 7 صفوف
2 _ الخاصية الفلزية تقل من اليسار الى اليمين
3 _ عدد مستويات الطاقة في الذرة العنصر يدل على رقم الدورة
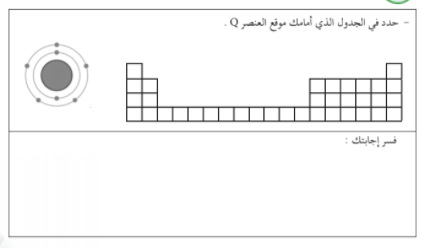
الشكل التالي يمثل التوزيع الالكتروني لعنصر افتراضي رمزه Q :
حدد في الجدول الذي امامك موقع العنصر Q
الشكل التالي يمثل نموذج الجدول الدوري ادرسه جيدا ثم اجب عن الاسئلة التي تليه :
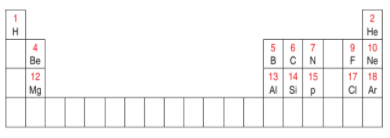
ضع العناصر التالية في مكانها المناسب من الجدول الدوري الحديث وفسر اجابتك :

ما اوجه كل من التشابه بين العنصرين 17Cl – F فسر اجابتك ؟
الروابط الكيميائية :
المادة اما ان تكون عنصرا مركبا و العنصر يوجد في حالة منفردة من مثل الغازاات النبيلة كالهيليوم و النيون و الارجون و يمكن ان يوجد في الفلزات كالالمنيوم و النحاس و الحديد في حالة صلبة كما يمكن ان يوجد في صورة جزيئية كمعظم جزيئات العناصر الغازية التي تتكون من ذرتين مرتبطتين من مثل الكاليوم و الاكسجين
هناك بعض العناصر اللافلزية جزيئاتها تحتوي على اكثر من ذرتين من مثل الكبريت و الكربون و الفسفور اما في المركبات فيتكون الجزيء من نوعين او اكثر من ذرات العناصر المكونة لها
صمم نموذجا للصيغة الجزيئية للمواد في الجدول التالي :
قدد تتساءل كيف ترتبط ذرتان لنفس العنصر لتكون جزيئا منه من مثل جزيء الاكسجين ؟
او كيف ترتبط ذرات العناصر المختلفة لتكوين مركبات من مركبات من مثل الماء او ملح الطعام ؟
من درستك للجدول الدوري الحديث لاحظت ان العناصر النبيلة تقع في المجموعة A 8 و هي اكثر العناصر استقرار لان المستوى الخارجي لذراتها مستقر بالالكترونات اما العناصر الاخرى فانها تميل للارتباط بعناصر اخرى لنصل الى حالة الاستقرار اما بالانتقال و اما بالمشاركة مع ذرات العنصر المرتبطة بها فما الرابظة الكيميائية ؟
تحقق من فهمك :
الايون هو الذرة التي فقدت او اكتسبت الكترونا او اكثر من مستواها الخارجي للوصول الى حالة الاستقرار
الايون السالب : معظم العناصر اللافلزية لديها قابلية لاكتساب الالكترونات لتصبح مشحونة بشحنة سالبة و اذا اكتسبت الكترونين تصبح مشحونة بشحنتين سالبتين و يكون حجم الايون السالب اكبر من حجم الذرة المتعادلة عدا العناصر النبيلة
الايون الموجب : العناصر الفلزية تميل لفقد الكترون او اكثر لتصبح مشحونة بشحنة موجبة و اذا فقدت الكترونين تصبح مشحونة بشحنتين موجبتين ويكون حجم الايون الموجب اصغر من حجم الذرة المتعادلة
الرابطة الكيميائية هي قوة التماسك التي تربط الذرات او الايونات بعضها مع بعض
الرابطة الايونية هي قوة التجاذب الكهربائي الساكن بين الايونات المختلفة في نوع الشحنات ..


